皆様こんにちは🤓
本日もよろしくお願いします。
今回の内容は「芳香族化合物の反応」についてです:-P
薬剤師国家試験の勉強において、有機反応というのは苦手な方にとってはかなりキツイものです🥺捨てたくなるかもしれません😟
ただ、反応の中には
“応用が利く(問われやすいもの)”
“ポイントだけでなんとかなる”
範囲が存在します。
前者は「加水分解反応」などが該当します。色々な所で出現するので重要です🤔
そして後者の代表例が、今回一緒に勉強する「芳香族化合物」の内容です。
芳香族化合物の反応に関しては、医薬品や生体成分に絡めた問題に応用されることは少ないです。
ただ、覚えるポイントは少なく、問われる内容がほとんど同じで勉強しやすいため、触れておくとよいでしょう🤓
重要ポイントを一緒に整理していきましょう☆
目次
芳香族化合物の反応とは
芳香族化合物の反応の代表例は「芳香族求電子置換反応」です🤓
薬剤師国家試験においては、ほぼこれしか出題されないと思ってよいです。
大事なことは以下3つ
①反応のイメージを持つこと
②「試薬」を見たら何の反応か分かること(ここは覚えるしかない)
③置換基による影響
②については問題を解きながら覚えていけば良いので、ここでは①と③を説明します。
芳香族求電子置換反応とは以下のような反応です。
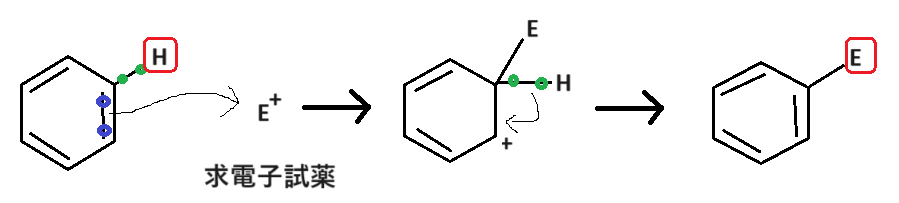
求電子試薬E+(電子が欲しい=プラスの試薬)が水素(H)と置き換わっているので、「求電子置換反応」です。
この求電子試薬E+は問題に書かれている試薬によって変化します。数は多くないため、過去問を解きながら覚えましょう🤓
反応は上の式になりますが、もう少しイメージで押さえてほしいことがあります。
ベンゼン環はπ電子(2重結合を作る電子)があり、電子豊富な化合物です。
よって以下のようなイメージを持っておきましょう:-P
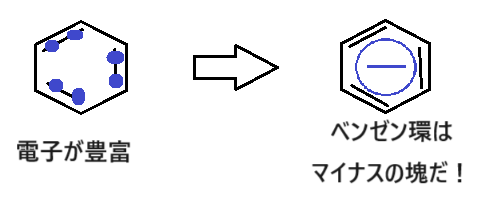
ベンゼン環は電子がたっぷりあるマイナスの塊です!
このイメージが、後で出てくる「反応性」の話で重要になります☺
反応性と配向性を決める「置換基効果」とは?
置換基効果(電子供与基や電子求引基)は、酸塩基の範囲でも重要でした🤓
ここで基本的な考え方をまとめておきます。
最終的に頭に入れたい表です。
| 置換基の例 | -NH2、-OCH3など | -CH3など(アルキル基) | ハロゲン | -NO2、-CF3など |
| 置換基の種類 | 電子供与基 | 電子供与基 | 電子求引基 | 電子求引基 |
| 反応性(ベンゼンと比べて) | 大きく上げる | 上げる | 下げる | (大きく)下げる |
| 配向性 | オルト、パラ | オルト、パラ | オルト、パラ | メタ |
| 電子効果 | 共鳴による供与>誘起効果による求引 | 誘起効果による供与 | 誘起効果による求引>共鳴による供与 | 共鳴による求引 又は(及び) 誘起効果による求引 |
結論から言うと、丸暗記でも対応可能です🤓
ただ、理由も併せて覚えたほうが記憶が長持ちすると思うので、置換基の種類ごとに説明をしていきます:-P
-NH2、-OCH3など
まずはこのグループです🤓こんな化合物のことですよ↓
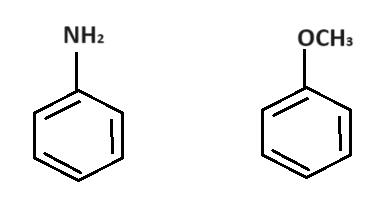
特徴はローンペアを持った原子(窒素や酸素)が、ベンゼン環のすぐ隣にあることです。
このグループは電子供与基です。
なぜでしょうか🤔結合している置換基を見てみます。
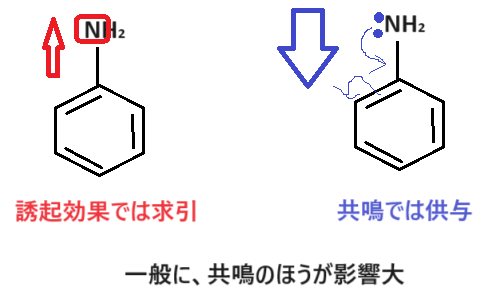
電気陰性度の大きい原子(窒素や酸素)があるため、誘起効果(電気陰性度による影響)では電子を求引します。また、ローンペアを持つため共鳴が起こり、ベンゼン環側に電子を供与します。
この時、一般的に影響度は「共鳴>誘起効果」であり、共鳴の効果が勝つため、このグループは電子供与基になります🤓ちなみに、この理由も試験で出題されてますよ🤮
またここから、なぜ求電子置換反応がオルト・パラ配向性になるかが説明できます☺
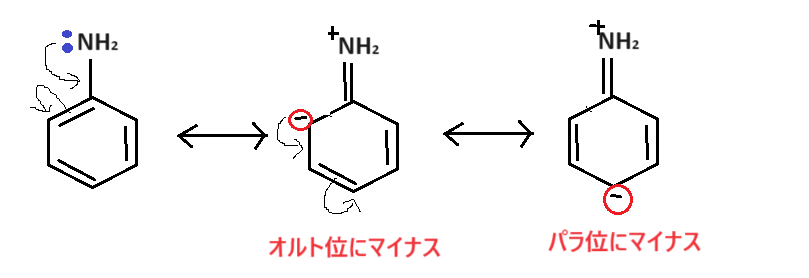
共鳴を書くと、マイナス部分がオルト位やパラ位にくるので、求電子試薬E+はオルト位やパラ位で反応するというわけです:-P
さらに、電子供与基ということはベンゼン環側に電子が流れ込んでいるので、ベンゼン環はより電子豊富な状態になっています。
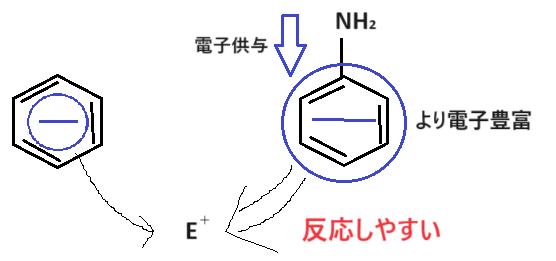
よって、イメージとしてはベンゼン環がよりマイナス状態になるため、求電子試薬E+と反応しやすくなります。
このグループの置換基効果は大丈夫でしょうか🤓表に戻って確認しておいてください☺
-CH3など(アルキル基)
次はアルキル基です🤓こんなやつ↓
考え方は基本的に-NH2、-OCH3のグループと同じです😚
ただ、共鳴は起こらず、誘起効果での供与のみです。
※厳密には超共役(σ共役)と言います
よって、求電子置換反応の反応性は上がりますが、-NH2、-OCH3のグループよりは上がりません。
えぇっと・・・これだけです( ゚Д゚)
これ以上掘り下げることがないので次いきます☺
-NO2、-CF3など
次はこのグループです🤓
このグループは電子求引基です。
なぜなのでしょうか?一緒に考えてみましょう☺
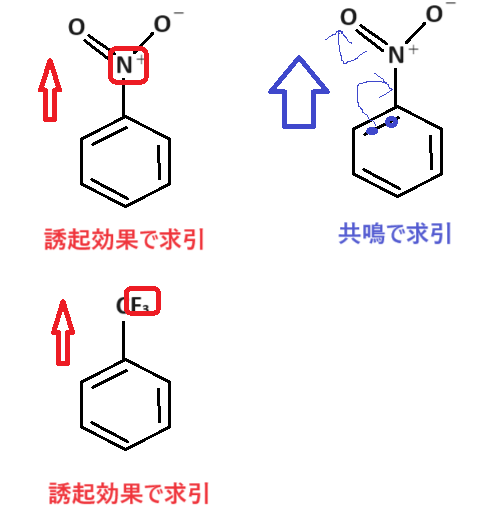
いかがでしょうか🤔
置換基によって、誘起効果のみだったり、共鳴効果もあったり差がありますが、どちらにしても求引しかしていません。
よって電子求引基になります:-P
特に-NO2は非常に強力な電子求引基です😚
また、配向性は以下のような感じです🤓
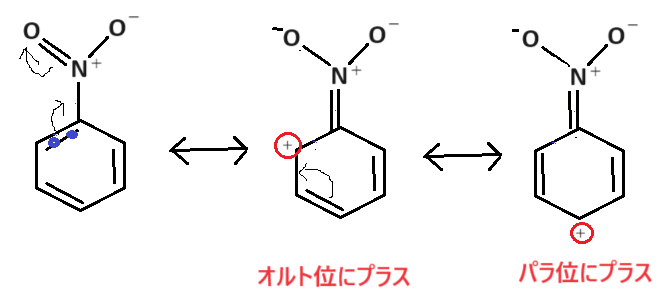
オルト位やパラ位にプラスがきてしまうので、求電子試薬E+は仕方なくメタ位に反応するというわけです😟
また、反応性はどうでしょうか。イメージできるでしょうか🤔
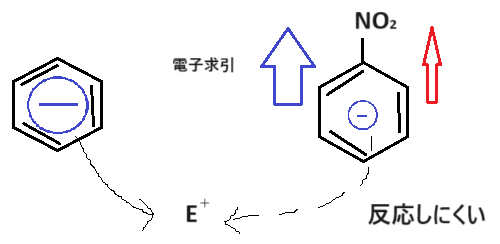
ベンゼン環より電子が少なくなり、反応性は下がります☺
ここまでよろしいでしょうか:-P
ハロゲン
最後はこちらです🤓
特殊な置換基なので、例外部分を間違えないようにしましょう😄
ハロゲンは電気陰性度が大きいため、誘起効果で求引します。また、ローンペアを持つため共鳴により電子を供与します。
では、-NH2、-OCH3のグループと同じでは?🤔と思うかもしれません。
しかし、ハロゲンは電子求引基です。
理由は、共鳴の影響が誘起効果の影響より小さいからです🤮
※共鳴の影響が小さい理由(これは余談です)
塩素を例に説明すると、周期表で炭素、窒素、酸素は第2周期、塩素は第3周期の元素です。よって、原子のサイズが大幅に違います。これにより、塩素と炭素間での共鳴の影響が小さくなると考えます。
では配向性や反応性はどうでしょうか。
配向性は、ローンペアの共鳴が起こるためオルト・パラ配向性です(-NH2、-OCH3のグループと同じ)。
しかし、反応性は既に説明したように電子求引基であるため、下がります。
ハロゲンは特殊なのでご注意ください🤮
再確認
再度載せておきますので、もう一度確認しておきましょう:-P
| 置換基の例 | -NH2、-OCH3など | -CH3など(アルキル基) | ハロゲン | -NO2、-CF3など |
| 置換基の種類 | 電子供与基 | 電子供与基 | 電子求引基 | 電子求引基 |
| 反応性(ベンゼンと比べて) | 大きく上げる | 上げる | 下げる | (大きく)下げる |
| 配向性 | オルト、パラ | オルト、パラ | オルト、パラ | メタ |
| 電子効果 | 共鳴による供与>誘起効果による求引 | 誘起効果による供与 | 誘起効果による求引>共鳴による供与 | 共鳴による求引 又は(及び) 誘起効果による求引 |
繰り返しになりますが、丸暗記でも対応可能です🤓
問題演習
最後に、実際の国家試験問題を解いてみましょう:-P
少し難しいですが、第105回の問104です🤓
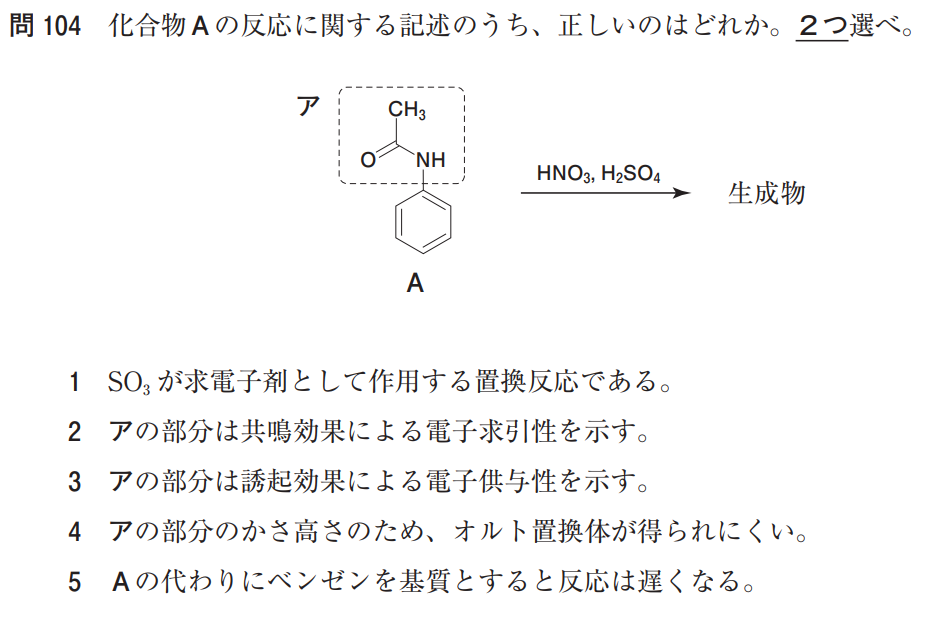
選択肢1
選択肢1は、試薬を見て何の反応か分からなければなりません。
「HNO3、H2SO4」とくればニトロ化です。
求電子試薬E+は、+NO2と考えればよいです。
よって、選択肢1は「誤」です。
選択肢2&3&5
構造を確認してみます🤓
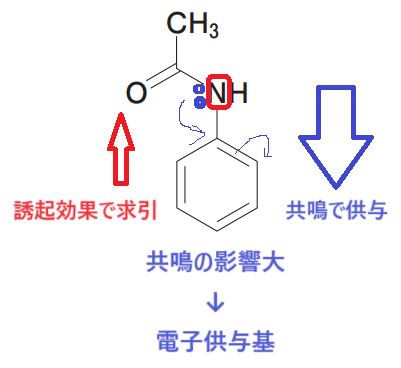
構造が少し複雑ですが、-NH2、-OCH3のグループと同じ電子供与基ですね🤓
共鳴により電子を供与し、誘起効果により電子を求引します。
よって選択肢2、3は「誤」です。
また、選択肢5は「正」です。
※補足ですが、この化合物の窒素のローンぺアは、カルボニル基側にも共鳴するため、電子供与基としての効果は-NH2より下がります。
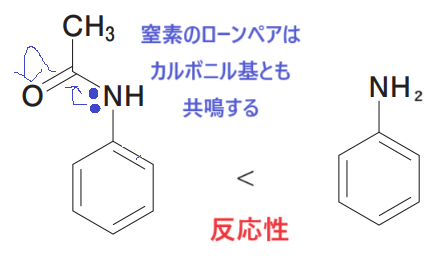
選択肢4
電子供与基のため、オルト・パラ配向性です。
さらに、オルト位とパラ位どちらに反応が起こりやすいかを問われています。
これは選択肢4の説明通り、置換基がかさ高い場合、オルト位は置換基の障害により反応が起こりにくく、パラ位に優先的に反応が起こります。
よって選択肢4は「正」です🤓
補足1
配向性について説明しましたが、国家試験では置換基が2つある場合の配向性についても出題されています🤓
例えば以下のような反応で、どちらの化合物が生成しやすいでしょうか?
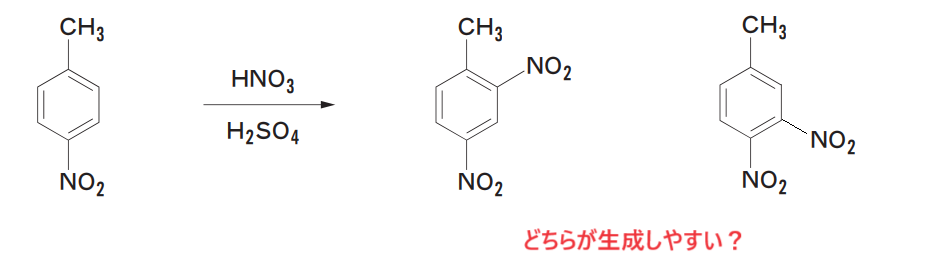
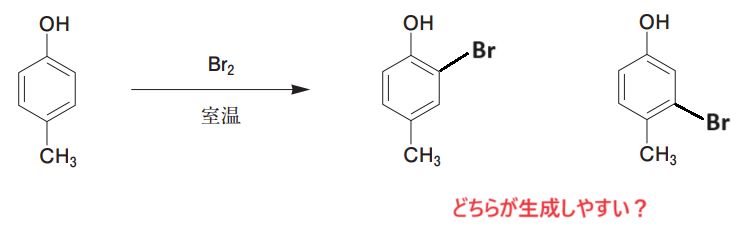
このように、置換基が複数ある場合もでも、配向性の考え方は全く同じです:-P
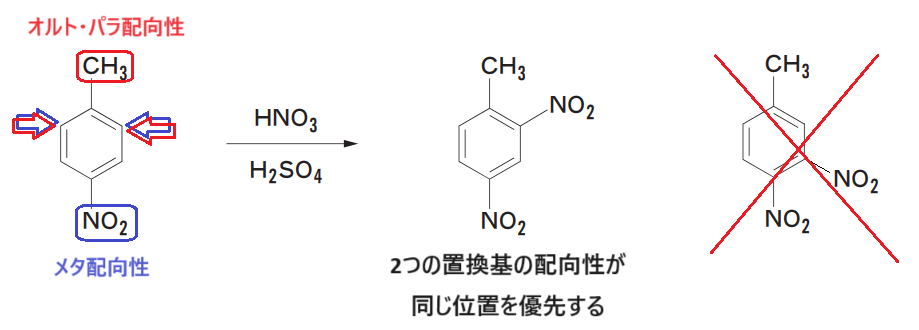

それぞれの配向性を考えます。
1つ目の例では、-CH3と-NO2の配向性により、優先される反応の位置が一致しているため、-CH3のオルト位かつ-NO2のメタ位に反応がしやすいと考えます。
2つ目の例では、-OHと-CH3はともにオルト・パラ配向性ですが、供与基として強い-OHの配向性が優先されるため、-OHのオルト位に反応がしやすいと考えます🤓
基本的な配向性が分かっていれば対応可能です!
補足2
最近の国家試験ではあまり出題されていませんが、ピロールやピリジンの求電子置換反応の反応性に関する問題も出題されています。
簡単ではありますが、説明しておきます:-P
結論からいくと、求電子置換反応の反応性は
ピロール>ベンゼン>ピリジン
です🤓
理由は以下のように考えてみましょう。
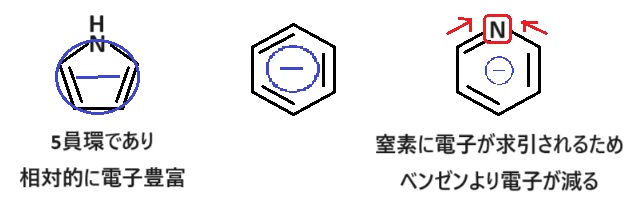
ピロール、ベンゼン、ピリジンは全てπ電子が6個の芳香族化合物です。
この中でピロールのみ5員環なので、相対的に電子豊富な状態です。
よって最も求電子置換反応が起こりやすいと考えられます🤓
次に同じ6員環のベンゼンとピリジンを比較すると、ピリジンは電気陰性度の大きい窒素が誘起効果により電子を引っ張るため、環のマイナスが減ります。
そのため、ベンゼンより求電子置換反応が起こりにくくなります。
最後に
いかがでしたか🤔
一番大事な部分は一通り網羅しているので、あとは問題を解いて出題のされかたを確認してみてくださいね☺
迷ったらこの一覧表に戻りましょう🤓
| 置換基の例 | -NH2、-OCH3など | -CH3など(アルキル基) | ハロゲン | -NO2、-CF3など |
| 置換基の種類 | 電子供与基 | 電子供与基 | 電子求引基 | 電子求引基 |
| 反応性(ベンゼンと比べて) | 大きく上げる | 上げる | 下げる | (大きく)下げる |
| 配向性 | オルト、パラ | オルト、パラ | オルト、パラ | メタ |
| 電子効果 | 共鳴による供与>誘起効果による求引 | 誘起効果による供与 | 誘起効果による求引>共鳴による供与 | 共鳴による求引 又は(及び) 誘起効果による求引 |
お疲れ様でした🤓