化学の勉強法、第3回目に突入しました。
前回、酸・塩基の重要ポイントである「どんな時に酸・塩基が強くなるか?」ということを説明しました。忘れた方は復習しましょう!
-

-
【全7回】薬剤師国家試験の化学勉強法 酸塩基 初めの一歩(第2回)
2026/1/3 酸・塩基
皆様こんにちは😄 前回、立体・酸塩基の勉強ポイントを説明しました。 ここからだんだん内容が本格的になりますが・・・皆様なら大丈夫でしょう🤓 繰り返しになりますが、全7回 ...
本日は「酸」に絞ってもう少し具体的な話をしていきます。
それでは始めましょう:-P
酸の強さを比較する
前回の重要ポイントを再度記載します
「共役塩基が安定=酸が強い」
これだけです。
今日はここを掘り下げます。
質問です
「共役塩基を安定化させるにはどうすればよいでしょう?」
これが分かれば酸の問題ほぼ終わり!
ちなみに“共役塩基”はプロトン(プラス)が外れた後のマイナスでしたね!
このマイナスの共役塩基を安定化させる方法は2つあります。それは・・・
①電子求引基をつける
②共鳴させる
です。
①はマイナス(要するに電子)を引っ張って安定にする
②はマイナス(電子)を動かして安定にする
ということです。
イメージはこうです。(絵がめっちゃ雑ですが、イメージが大事です)
①電子求引基をつける
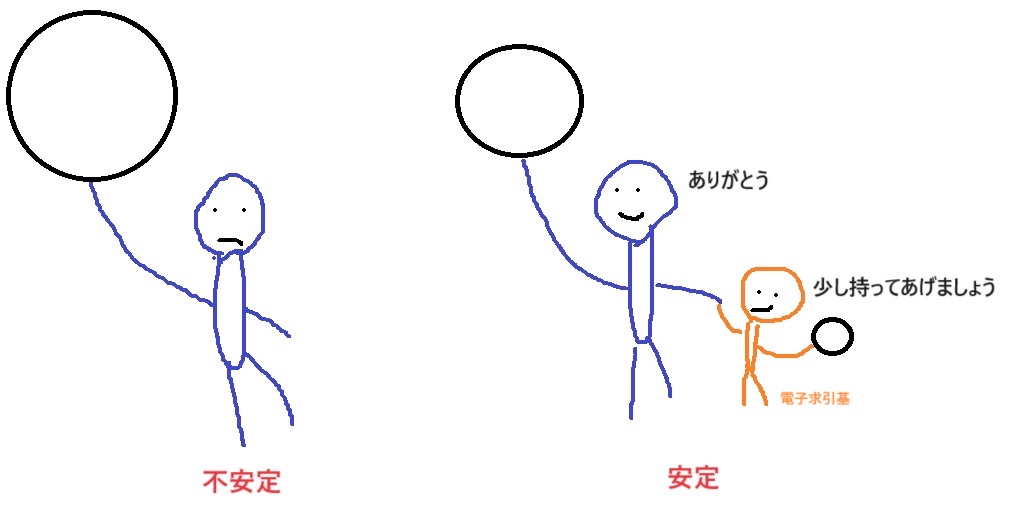
マイナス(電子)が1ヵ所に固まっていると、バランスが悪くて不安定なので、電子求引基(マイナスを引っ張るもの)で吸い取って偏りをなくして安定にしよう!という感じ。
②共鳴させる
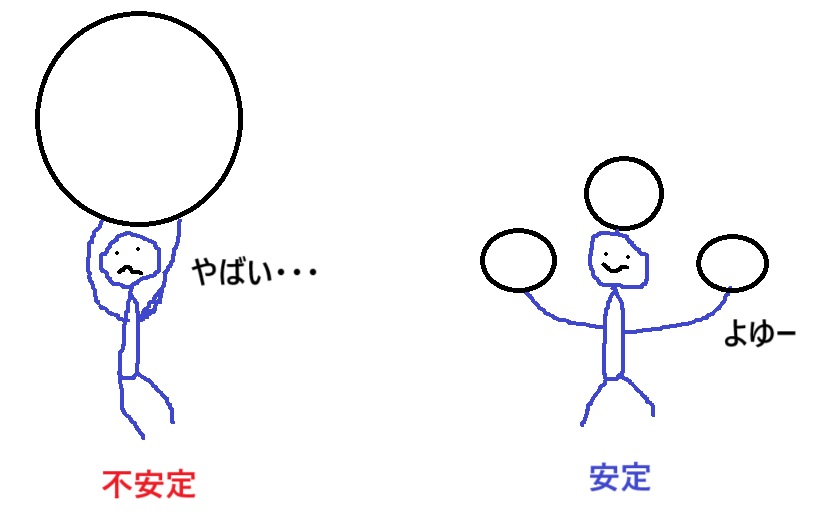
共鳴の詳細な原理は割愛しますが、“共鳴=電子を動かす”ということなので、1ヵ所に固まったマイナス(電子)を動かして、バラバラにしたら偏りがなくなって安定化されるね!という感じ。
国家試験では①を使うことが多いです。(共鳴パターンはこちらの記事で☺)
例えばこんな問題
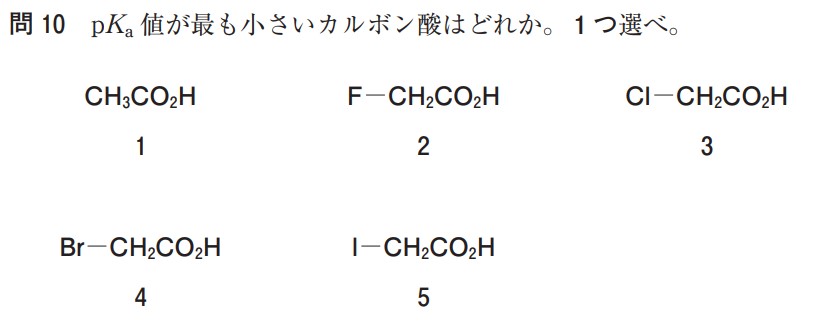
第103回の過去問です。(これ間違ったらあかんけど、逆にこんな問題でも正解で1点です。激ムズ計算問題も1点、こんな問題も1点です。)
さて、皆様はこの問題が“理由をつけて”解ける状態になる必要があります。
ちなみに「pKaが小さい=酸が強い」です。
では早速解説です。
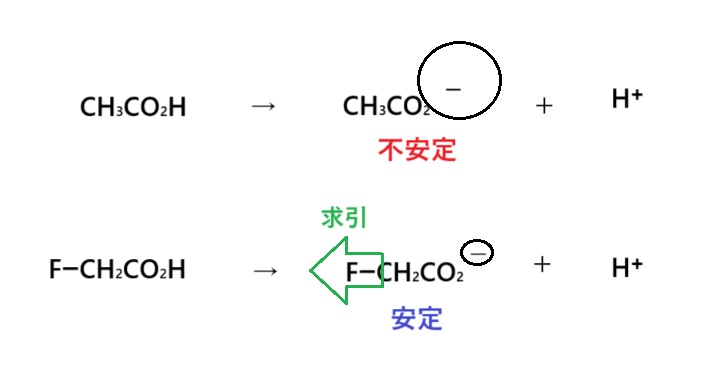
この問題は本日学習したパターンでいくと「①電子求引基をつける」です。
フッ素、塩素、臭素、ヨウ素はハロゲンと呼ばれ、電気陰性度(電子を引っ張る力)が大きい元素です。電気陰性度の大小関係は「フッ素>塩素>臭素>ヨウ素」なので、一番引っ張る力が強いのはフッ素です。
よって、共役塩基が最も安定で一番酸が強いのは「2」ということになります。
次は第106回の問題です。
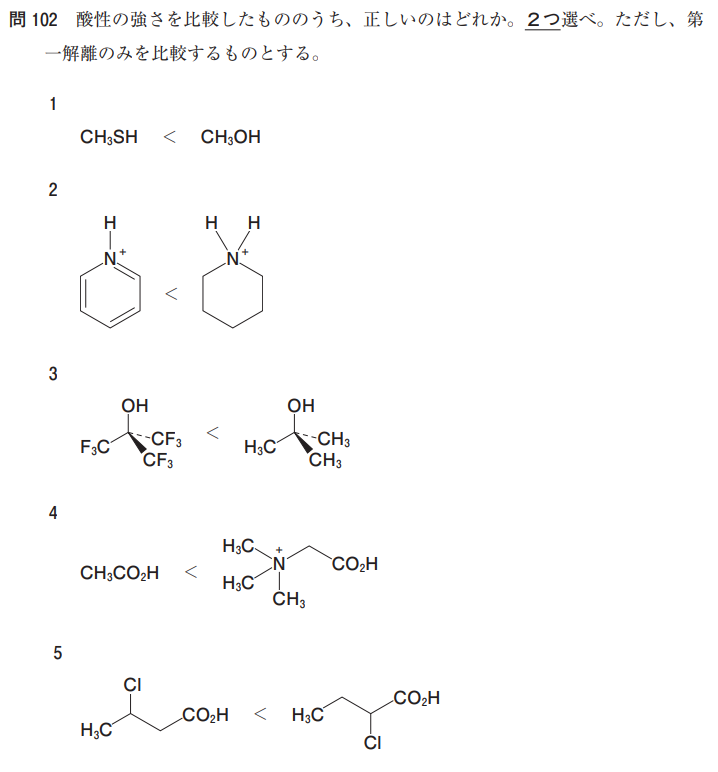
大事なのは選択肢3~5です☺
「共役塩基が安定=酸強い」です。
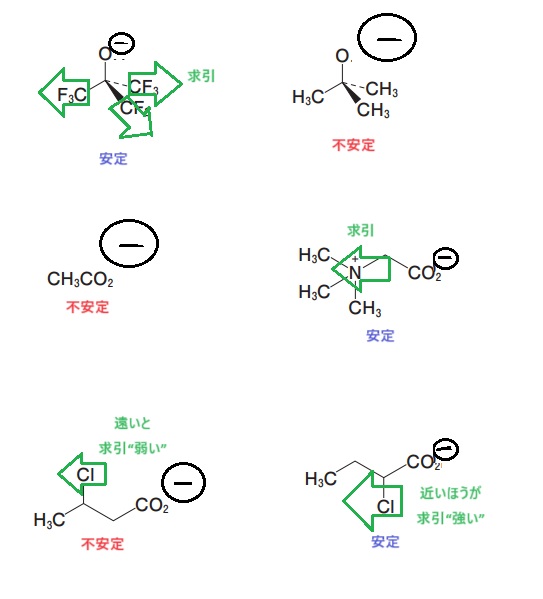
共役塩基の安定性を比較して、酸の強さを考えましょう!
答えは4と5ですね:-P
選択肢5はあまり国家試験で出ていない考え方ですが、求引基が近いほうが引っ張る力が強いと考えましょう☺
ちなみに・・・
選択肢1は下の“ちょっと補足”をご確認ください。チオール>アルコールです。
選択肢2は「共役酸」というものです。
塩基性の勉強をしてから確認いただければOKです。塩基が強い→その共役酸は弱いです。
-

-
【とりあえずこれだけ!】共役塩基とは?共役酸とは?
2025/12/10 酸・塩基
皆様こんにちは:-P まだまだ寒い日が続きますので体調にお気をつけください☺ 本日は酸・塩基の補足で「共役塩基と共役酸」のポイントをお伝えします! 国家試験では時々、共役塩基や共役酸の強 ...
酸性度比較として大事なのは選択肢3~5ですよ!!!
ちなみに「②共鳴させる」パターンは、最近あんまり出てないです・・・
ちょっと補足①
共役塩基を安定にする方法として2つ紹介しましたが、国家試験では覚えておいたほうが便利な酸の大小関係があります。(※もちろん理由はありますが、重要度がそこまで高くないため暗記したほうが早いです。余裕があれば理由も確認してみてください。)
それが以下の大小関係です。
★覚えたほうが早い★
カルボン酸(酢酸など)>炭酸>フェノール>チオール>水>アルコール
“カルタフェチミア”という謎の語呂もあります。どうぞ。
ちょっと補足②
一般的に「カルボン酸」や「フェノール」を使った酸性度比較が出題されやすいですが、他にも酸性を示す構造がたくさんあります。
代表的なものを例として紹介しておきます☺
強さの比較というより、酸性を示すことを知っているほうが重要なものです。あくまで一例ですが確認しておきましょう:-P(酸性を示す理由は同じく“共役塩基が安定”だからです)
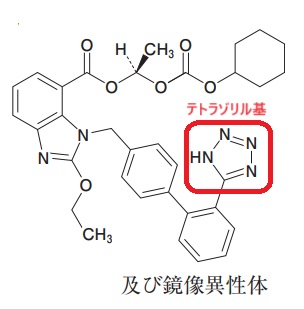
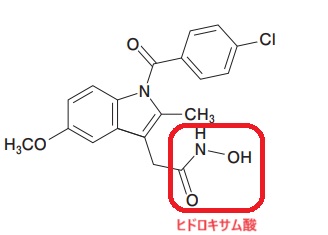
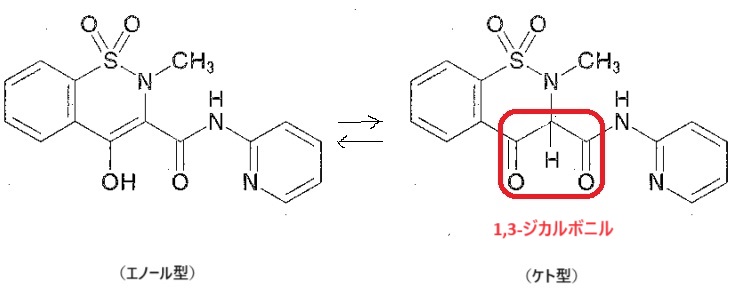
※1,3-ジカルボニルについては、古い国家試験で酸性度の比較問題が何度も出題されています。
まとめ
さて、いかがでしょうか。
「こんなのは簡単だ、誰でもできる」と思っている方!
その通りです。
「化学」ではこういう問題を落とさず確実に得点することが重要です。
また、この考えを理解していれば、一部難問を除き、国家試験レベルの問題を理解することは容易です。ついでに言うと“難問”は受験生の大半が解けませんので、勝負所ではないです。
まずは確実に「必ず得点しなければならない問題」を「当たり前に解ける」状態に近づけていきましょう。
次回は「塩基」の考え方を一緒に学習しましょう。お疲れさまでした。
-

-
【全7回】薬剤師国家試験の化学勉強法 “塩基”の強さ比較(第4回)
2026/1/3 酸・塩基
こんにちは皆さま。 今日は「塩基」の詳細を説明します。 「塩基」は、医薬品の構造に関する問題に絡めやすいため、「酸」よりも出題頻度は高めです。その分、酸よりも学ぶことは少し多めです・・・長いですがお付 ...