いつもブログをご覧いただきありがとうございます:-P
以前のブログで話を飛ばしてしまった「芳香族性」の内容を、国家試験突破レベルでさくっと説明します。ちなみに芳香族性だけで1問出題されることもあります(^^ すなわちこの投稿で1点です:-P
以下の化合物の芳香族性が説明できれば終了です。
①ベンゼン
②ピリジン
③ピロール
他の化合物も出題されますが、考え方がわかれば応用できます。
今から色々説明しますが、この言葉を頭に入れた状態で読んでください。
「芳香族化合物は“安定”。もし芳香族化合物になれるなら“なりたい”」
早速始めましょう!!!
芳香族性とは何か
難しい話は無しでいきましょう。国家試験突破レベルの話です。
例えば代表的な化合物である“ベンゼン”は芳香族性を示す芳香族化合物です。
すなわち、芳香族性とは「芳香族化合物になる条件」ということでOKです。
芳香族化合物になる条件とは
芳香族化合物になるには「芳香族性を示す」必要がありました。
ではその条件とは何か?
この条件と3つの化合物「ベンゼン」「ピリジン」「ピロール」を理解すれば、国家試験の芳香族性は終了です。
【条件】
・環をつくる原子は全てsp2混成軌道
・π電子が(4n+2)個(n=0,1,2・・・)
この2つです。問題解く際に確認する条件はこれだけなんです。
ただし、大前提としてこの考えを頭に入れておかなければなりません。冒頭でお伝えしたアレです。
「芳香族化合物は“安定”。もし芳香族化合物になれるなら“なりたい”」
それでは実際の化合物を使って説明しますね:-P
具体例
ベンゼン
ベンゼンが芳香族化合物であることは当たり前となっている方が多いかもしれませんが、「なぜ芳香族化合物と言えるのか」を改めて確認します。一番基本なので。
条件2つを満たすかどうかチェックしましょう。初めに「混成軌道」と「π電子」の話をさらっといきますね。
・sp2混成軌道
s軌道1個とp軌道2個がくっついた軌道でした。この時、sp3混成軌道よりpが1つ少ないですよね。すなわち、p軌道が1つ余っている状態です。条件1つ目の「環をつくる原子は全てsp2混成軌道」は「環をつくる原子は全てp軌道をもつ」とも言えます。
・π電子
π電子は「p軌道に入っている電子」で、主に2重結合を作る電子です。
条件1つ目が「p軌道」をもつことでしたが、このp軌道に入った電子(π電子)の数が重要というわけです。
「π電子が(4n+2)個(n=0,1,2・・・)」とは、すなわちπ電子が、2個、6個、10個・・・の場合ですね。
では、「ベンゼン」は芳香族化合物になる条件を満たしているのでしょうか?

まずはsp2混成軌道かどうかですね!これは問題なさそうです。
次にπ電子ですが・・・

数も大丈夫です!
二重結合をつくるのはp軌道に入った電子、すなわちπ電子です。
結合1本は電子2個からできてますので、上図のように数えます。
これでベンゼンが芳香族化合物であることが示されました!
同じ考え方で、以下のような化合物も国家試験に出題されていますよ😚
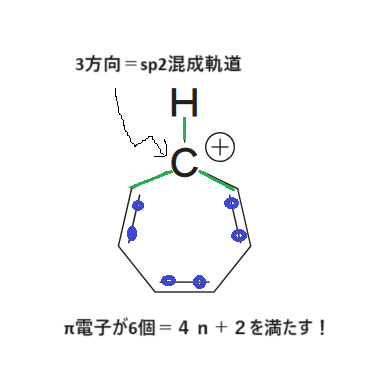
同じですね:-P
ピリジン
ピリジンの場合もベンゼンと全く同じ考えです。
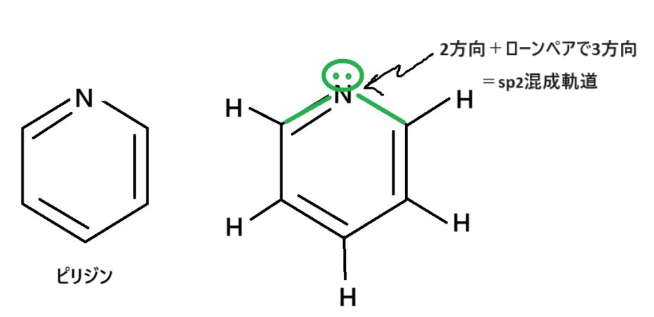
混成軌道は窒素も炭素も問題ないし

π電子もOK
すなわちピリジンも芳香族化合物です。
ちなみに、上の図の通り、ピリジンのローンペアはsp2混成軌道に入っていますよ😄
だからまぁまぁ強い塩基性も示します!(塩基性の強さはローンペアが入った軌道がsp3>sp2>spの順でした:-P)
-

-
【全7回】薬剤師国家試験の化学勉強法 “塩基”の強さ比較(第4回)
2026/1/3 酸・塩基
こんにちは皆さま。 今日は「塩基」の詳細を説明します。 「塩基」は、医薬品の構造に関する問題に絡めやすいため、「酸」よりも出題頻度は高めです。その分、酸よりも学ぶことは少し多めです・・・長いですがお付 ...
ここまではスムーズに来れましたか?
さて、最後にピロールです。これが芳香族性を勉強する際の最大にして唯一の関門です。
ここで大事になるのが本日3回目登場のこの言葉
「芳香族化合物は“安定”。もし芳香族化合物になれるなら“なりたい”」
大事な理由は説明をしながら・・・
難敵“ピロール”を攻略する
確認することは同じなんですけど。ちょっとだけ考え方が違うんです。
では同じように図で確認しましょう。
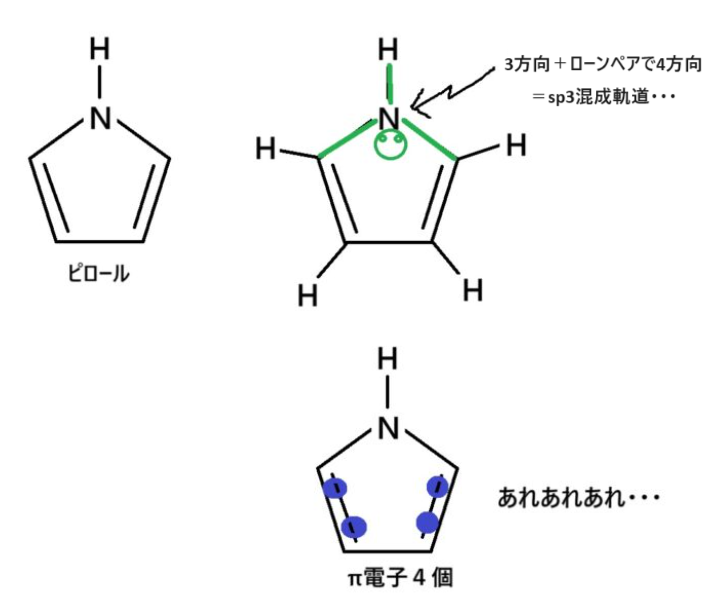
んん?
ピロールは芳香族化合物ではないという結果が出ました。
判断の仕方は正しそうに見えるのです。
が!これは“誤り”です。何がおかしいかというと
芳香族化合物になる気合が足りていないんです。
「芳香族化合物は安定やから、頑張って芳香族化合物になりたいんやろ??じゃあもっと気合入れろよ!」ってな感じです。
ちょっと気合いれてみますね。

まずはsp3混成軌道をとろうとする窒素を、気合でsp2混成軌道にします。
あとはπ電子ですね。
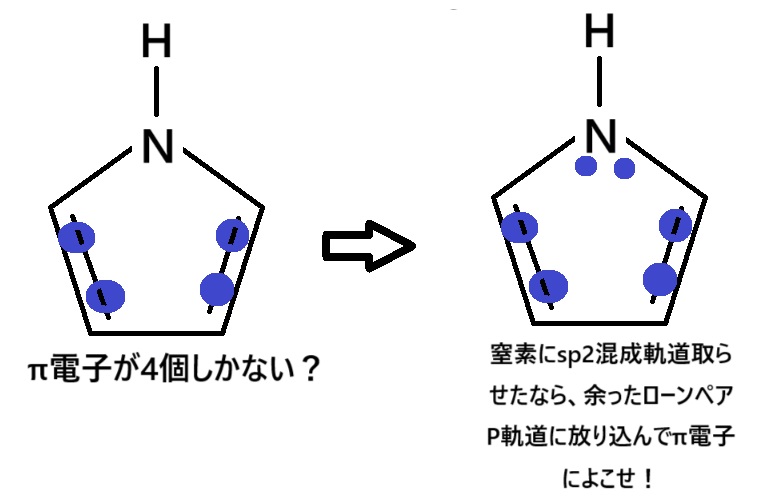
窒素にsp2混成軌道をとらせたということは、窒素はp軌道もってますね。
p軌道にローンペアを入れるとπ電子が2個増えるので、全部で6個になります。
すなわち、ピロールは芳香族化合物になれました。
“気合”とは言いましたが、何度もお伝えしているように
「芳香族化合物は“安定”。もし芳香族化合物になれるなら“なりたい”」
です。化合物は不安定な状態より安定な状態を目指します。よって芳香族化合物になれるなら、それを目指すわけです。
ピロールの窒素が、カルボアニオンになった下図のような化合物も国家試験に出題されています。
考え方は同じなので確認しておきましょう☺
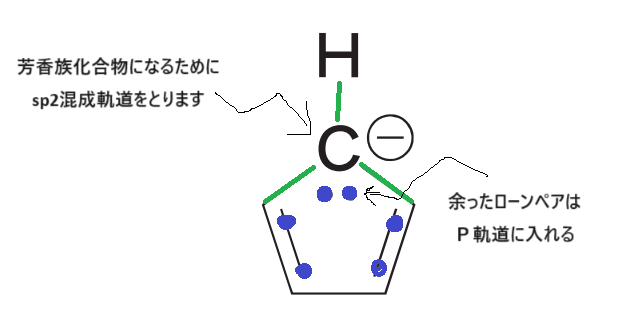
補足
薬剤師国家試験では、医薬品の構造と絡めて芳香族性を問われることが多いです。
実際に国家試験に出題された構造をいくつか紹介しておきます。考え方は全て同じです😚
まずは、108回の問108で出題された芳香族性の問題から。
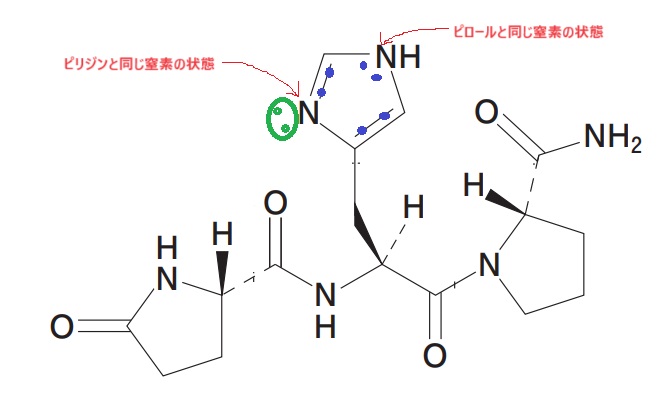
イミダゾール環は芳香族性を示します。一方の窒素はピリジンと同じ状態、もう一方の窒素はピロールと同じ状態です。
続いて101回の問209の問題
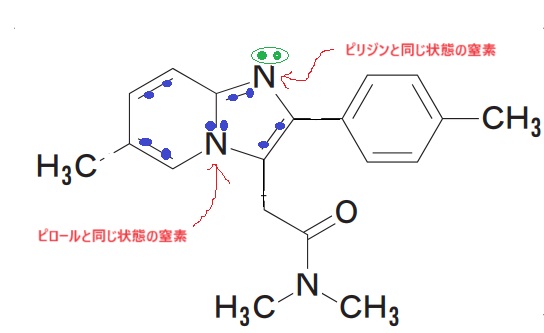
これも考え方は同じです。今回は4n+2のn=2の時です。π電子が10個です🤔
まとめ
いかがでしたか。
芳香族性の重要点は頭に入ったでしょうか。
この記事の内容を最後まで理解することができれば、国家試験では何も恐れるものはありません。
安心してください。
あとは過去問を解いて、他の化合物でも同じ考え方が出来ることを学んでください。
では本日は以上です、お疲れさまでした(^^)