こんにちは皆さま。
今日は「塩基」の詳細を説明します。
「塩基」は、医薬品の構造に関する問題に絡めやすいため、「酸」よりも出題頻度は高めです。
その分、酸よりも学ぶことは少し多めです・・・長いですがお付き合いください。
なお、「塩基」の範囲をしっかり理解するためには、“軌道”や“芳香族性”といった内容を学ぶ必要がありますが、話が長くなるため最低限のこと以外は省略しています。
-

-
【とりあえずこれだけ】薬剤師国家試験の芳香族性
2025/12/10 芳香族
いつもブログをご覧いただきありがとうございます:-P 以前のブログで話を飛ばしてしまった「芳香族性」の内容を、国家試験突破レベルでさくっと説明します。ちなみに芳香族性だけで1問出題されることもあります ...
では「塩基」の考え方を一緒に学んでいきましょう!
塩基の強さを比較する
さて、塩基の強さは何で決まるかもう大丈夫でしょうか。
・・・
そうです!
“窒素にどれだけ「マイナス」が集まっているか”でした。
マイナスがあるほうが、プロトン(H+)を捕まえやすいんですよね!
では、塩基を強くしたいので、窒素にマイナスを集める方法を3つ確認しましょう。
①窒素のローンペアがsp3混成軌道に入っている
②電子供与基をつける
③窒素のローンペアが共鳴しない
それぞれ説明を加えていきます。
①窒素のローンペアがsp3混成軌道に入っている
いきなりきました“軌道”です・・・そうなんです、軌道の考えが必要です。
※ただし、薬剤師国家試験で軌道に関して詳細を問われる可能性はほとんどなく、もし出題されても誰もできません!軌道の考えが必要な範囲は限られているため、今日も最低限のことだけ説明します。
【軌道の超簡易説明】
軌道とは“電子が入る部屋”です。s軌道やp軌道という“部屋”があります。
この電子が入った部屋がつながることで、結合(共有結合)ができます。
すなわち、「軌道=原子の手の数(手が伸びている方向)」と言うこともできます。
例)メタンとアンモニア

s軌道とp軌道を混ぜて、新しい部屋を作ることができます。これを“混成軌道”と言います。(国家試験では以下3つ)
・s軌道1つ+p軌道3つ=sp3混成軌道
・s軌道1つ+p軌道2つ=sp2混成軌道(p軌道1つ余り)
・s軌道1つ+p軌道1つ=sp混成軌道(p軌道2つ余り)
上記のことから、メタンとアンモニアを例にまとめると
メタンの場合、「炭素原子は手が4本(4方向)=軌道が4つ」なので、sp3混成軌道です。
アンモニアの場合、「窒素原子は手が4本(4方向)=軌道が4つ」なので、同じくsp3混成軌道です。
また、この時の窒素のローンペアは、sp3混成軌道に入っています。
ちなみに、混成軌道は、混ぜる軌道の数が違うので、sp3混成軌道のほうが広く、sp混成軌道のほうが狭いです。
軌道は細かいことを考え出すと難しいのですが、国家試験の問題を解くだけなら、単純に手の本数(手が伸びている方向)と同義であると考えてしまって問題ありません。
では、最初の話に戻りましょう。窒素のローンペアがsp3混成軌道に入ると、どうして塩基が強いといえるのでしょうか。イメージ図をご確認ください。
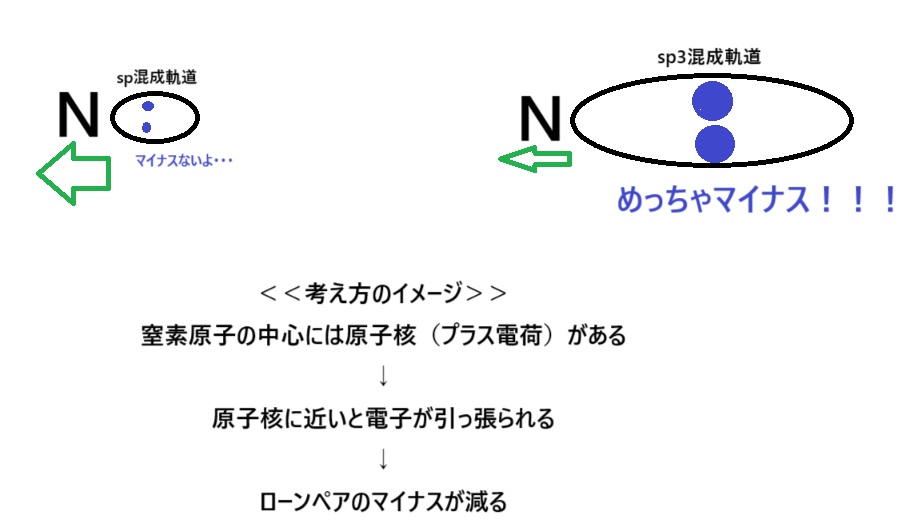
こんな感じです。
sp3混成軌道にローンペアが入ると塩基が強いというより、軌道が狭い(sp混成軌道など)とプラスに帯電した原子核にローンペアが引っ張られて、プロトンを捕まえる力が弱っているため、塩基性が弱くなると考えたほうがよいかもしれませんね。
色々書きましたが、結論だけ覚えていてもOKです。
結論「塩基の強さ:窒素のローンペアが sp3混成軌道>sp2混成軌道>sp混成軌道」
安心してください。これで問題解けますので。
②電子供与基をつける
塩基を強くする方法2つ目は「電子供与基をつける」です。
電子供与基とは、その名前の通り“電子(マイナス)を与える”ものです。
これは分かりやすいのでイメージ図で完了させましょう。
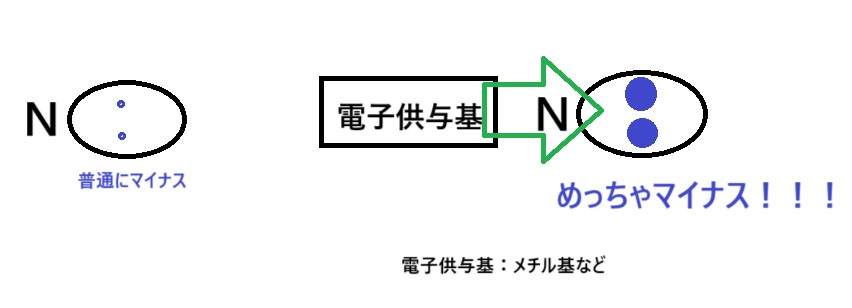
これは大丈夫でしょうか。
電子供与基をつけると、窒素にマイナスが集まりますので、塩基は強くなります!
③窒素のローンペアが共鳴しない
これもイメージ図で終了です!
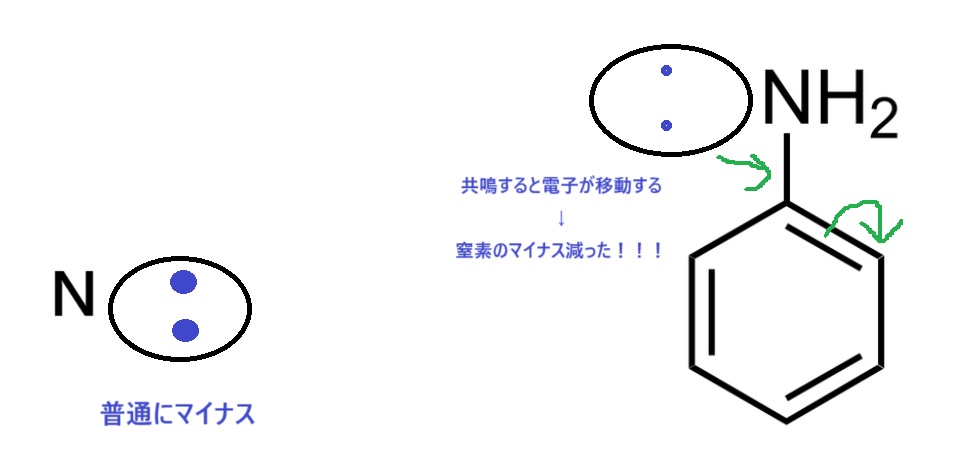
窒素のローンペアが共鳴(電子が動く)すると、窒素のマイナスが減ります!すると塩基が弱くなります。
よって、窒素のローンペアは共鳴しないほうが塩基が強いです。
問題解説と国家試験の秘策
ここまでの内容いかがでしょうか。塩基が強い条件3つ、必ず理解しておきましょう。
最後に過去問を見てみますが、その前に“国家試験の秘策”を伝授します。
塩基の問題が出題された時は、必ずこれらを見つけてください。
それは
・アミド
・ピロール
・ニトリル、ニトロ
です。
これ何?という感じですが、全て“塩基性を(ほぼ)示さない窒素含有の構造”です。
すなわち、「塩基が強いのはどれ?」という問題で、必ず「弱い」と判断できるものです。問題を解く際には最初に確認して選択肢を削ってください。特に上2つが出題されやすいです。
ピロールが塩基性をほぼ示さない理由は、芳香族性の学習をすれば理解できます。本日は省略しますが、簡単に言うと「窒素のローンペアが環の中を“共鳴”しているため」です。共鳴すると塩基が弱くなりましたね!
-

-
【とりあえずこれだけ】薬剤師国家試験の芳香族性
2025/12/10 芳香族
いつもブログをご覧いただきありがとうございます:-P 以前のブログで話を飛ばしてしまった「芳香族性」の内容を、国家試験突破レベルでさくっと説明します。ちなみに芳香族性だけで1問出題されることもあります ...
では問題です。第102回の過去問です。
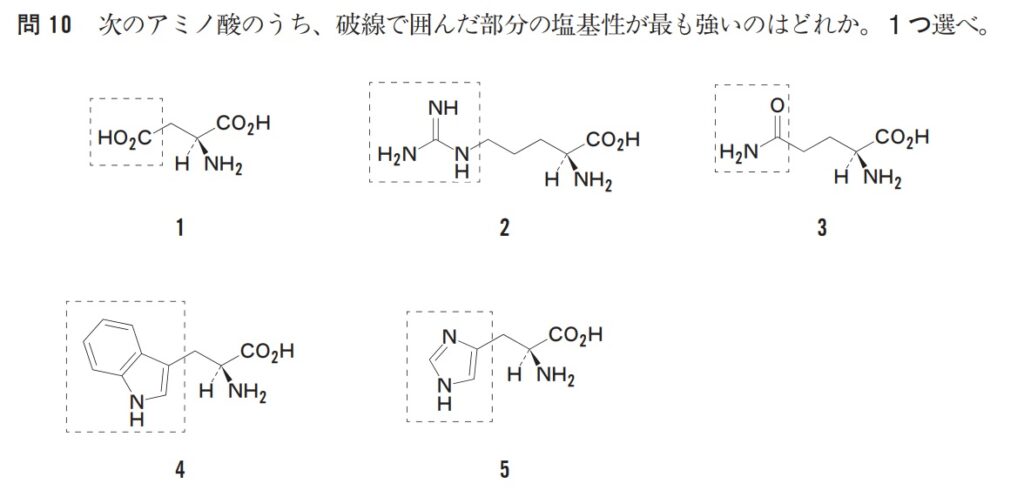
塩基が強いものは?と聞かれているので、「1」はない。さらに、「3」(アミド)、「4」(ピロールと同じ)も削れます。
最後に残った「2」「5」どちらの塩基が強いでしょうか。「2」が少し厄介なのですが、あまり難しく考えずにいきましょう。ちなみに同じような問題が第104回にも出題されています。

まずは「5」です。これは窒素のローンペアが2種類あり、一方はsp2混成軌道に入っており、もう一方はp軌道に入っています。後者はピロールと同じなので、ローンぺアが環の中を共鳴しており塩基性をほとんど示しませんでした。
次に「2」です。

本来は、プロトンを捕まえた後の構造が安定だから・・・という説明になるのですが、今まで学んだ考えで十分です。
「窒素にめちゃくちゃマイナスあるやん!!!」です。
これはグアニジノ基と言う構造で、共鳴によって窒素上にローンペアが集まってきています(ローンペアはsp3混成軌道に入っている)。よって「窒素がめちゃくちゃマイナスになってプロトンを捕まえやすい=塩基が強い!」という感じです。
したがって、この問題の答えは「2」です。
※共鳴してるから塩基弱いんじゃ?という質問を過去に何度も受けたことがありますが、共鳴で塩基が弱くなるのは「共鳴により窒素のマイナスが減った時」でしたから、今回の話とは違います。
まとめ
お疲れ様でした。
「酸」に比べるとボリュームありましたが、重要事項が多いので良く復習してください。
塩基が強い条件3つ(窒素にマイナスが集まる条件)
①窒素のローンペアがsp3混成軌道に入っている
②電子供与基をつける
③窒素のローンペアが共鳴しない
このポイントを頭に置いて、色々な問題にチャレンジしてみてください。きっと問題を見る目が変わっていると思います。
今回省略した芳香族性の説明は別の記事でしてますからこちらも要チェックです→芳香族性はこちら
それでは本日もお疲れさまでした。ありがとうございました。次回からは「立体化学」です。
-

-
【全7回】薬剤師国家試験の化学勉強法 立体 初めの一歩(第5回)
2026/1/3 立体化学
いつもブログをご覧いただきありがとうございます。 第5回となりました。 本日から「立体化学」に突入します。 第1回でお伝えしましたが、立体化学も頻出(というか出題率100%)範囲です。 ポイントは以下 ...